TEORI ATOM
TEORI ATOM
Pada beberapa abad sebelum masehi, filsuf-filsuf Yunani, di antaranya Leucippus dan Democritus berpendapat bahwa semua materi terdiri dari partikel-partikel kecil yang tak terbagi. Democritus menyatakan bahwa jika suatu materi dibagi menjadi bagian yang lebih kecil kemudian terus dibagi lagi maka akan sampai pada suatu saat di mana didapat bagian yang sangat kecil yang tidak dapat dihancurkan atau dibagi lagi yang disebut atom (‘’atomos’’ dalam bahasa Yunani yang artinya “tak terbagi”
Perkembangan model atom dari waktu ke waktu
(Sumber: Stacy, Angelica M. 2015. Living by Chemistry (2nd edition). New York: W.H. Freeman and Company)
A. Teori Atom Dalton (1803)
Teori atom dalton merupakan teori atom pertama yang dikemukakan oleh John Dalton (1808), seorang fisikawan asal Inggris. Dalam mengemukakan teorinya terkait struktur atom yang berdasarkan penelitian yang dikemukakannya dalam A New System of Chemical Philosiphy. Dimana John Dalton menjelaskan bahwa atom merupakan suatu zat yang tidak dapat dibagi lagi dan merupakan struktur terkecil dari suatu materi.
Model Atom Dalton Sumber: www.wikipedia.com
Bentuk atom yang digambarkan berdasarkan teori atom Dalton ini berbentuk bola kecil yang menjadi inti atom. Kemudian, setiap atom yang bergabung akan membentuk senyawa dan menjadi materi.
B. Teori Atom J. J Thomson (1904)
Perkembangan teori atom yang kedua dikemukakan oleh J. J Thomson. Penemuan tabung katoda oleh William Crookers membantu J. J. Thomson dapat menemukan teori atom baru. Melalui ltabung katode, J. J Thomson memastikan bahwa sinar katode merupakan partikel karena dapat memutar baling-baling yang diletakkan diantara katode dan anode.Hasil dari percobaan ini membuktikan bahwa sinar katode merupakan partikel penyusun atom yang bermuatan negatif (selanjutnya disebut elektron). Secara ringkas, Thomson menyimpulkan bahwa atom adalah bola padat bermuatan positif dan di dalamnya tersebar elektron yang bermuatan negatif. Model atom Thomson digambarkan seperti kismis(elektron) yang berada pada roti (atom).
Sumber: Enjiner.com
C. Teori Atom Rutherford (1911)
Teori atom Rutherford muncul berdasarkan eksperimen hamburan sinar alfa dari uranium. Rutherford bersama dua orang muridnya (Hans Geigerdan Erners Masreden) melakukan percobaan yang dikenal dengan hamburan sinar alfa .Partikel alfa adalah partikel yang bermuatan positif dan bergerak lurus dan berdaya tembus besar, sehingga dapat menembus lembaran tipis kertas.Awalnya, percobaan tersebut bertujuan untuk menguji pendapat Thomson mengenai atom berupa bola pejal yang bermuatan negatif. Hasil dari percobaan Rutherford adalah hampir semua partikel alfa diteruskan. Jika lempeng emas tersebut dianggap sebagai satu lapisan atom-atom emas, maka didalam atom emas terdapat partikel yang sangat kecil yang bermuatan positif.
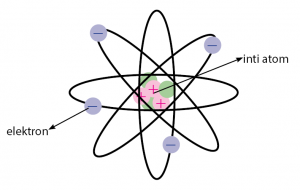
Kemudian Rutherford mengusulkan model atom yang menyatakan bahwa Atom terdiri dari inti atom (bermuatan positif) yang sangat kecil dan dikelilingi oleh elektron (bermuatan negatif).
Ilustrasi teori atom yang dikemukakan Rutherford dalam gambar dapat dilihat serti berikut.
(Sumber:https://idschool.net/sma/perkembangan-teori-atom/)
Secara ringkas, kesimpulan teori atom Rutherford diberikan pada daftar di bawah.
Kesimpulan Teori Atom Rutherford:
1. Atom bukan merupakan bola pejal.
2. Atom terdiri dari inti atom yang sangat kecil dan bermuatan positif.
3. Inti Atom dikelilingi oleh elektron yang bermuatan negatif.
4. Di dalam inti atom juga terdapat partikel netral yang berfungsi mengikat partikel-partikel positif agar tidak saling tolak menolak.
D. Teori Atom Niels Bohr (1913)
Perkembangan teori atom terus berlanjut pada tahun 1913, Niels Bohr mengembagkan teori model atom Rutherford menggunakan percobaan spektrum hidrogen. Percobaan ini berhasil memberikan gambaran keadaan elektron dalam menempati daerah disekitar inti atom. Penjelasan Bohr tentang atom hidrogen melibatkan gabungan antara teori klasik dari Rutherford dan teori kuantum dari Planck.Empat postulat hasil percobaan Niels Bohr:
1. Hanya ada seperangkat orbit tertentu yang diperbolehkan bagi satu elektron dalam atom hidrogen. Orbit ini dikenal sebagai keadaan gerak stasioner elektron dan merupakan lintasan melingkar disekeliling inti.2. Elektron tidak memancarkan atau menyerap energi selama elektron berada dalam lintasan stasioner, sehingga energinya tetap.
3. Elektron hanya dapat berpindah dari satu lintasan stasioner ke lintasan stasioner lain.
4. Lintasan stasioner yang dibolehkan memilki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut.
Dalam bentuk gambar, ilustrasi teori atom Bohr dapat dilihat seperti berikut.
(Sumber:https://idschool.net/sma/perkembangan-teori-atom/)
Atom terdiri atas inti atom yang bermuatan positi dan elektron-elektron yang mengelilingi inti atom pada lintasan-lintasan tertentu. Litasan-lintasan tersebut disebut kulit elektron atau tingkat energi. Tingkat energi paling rendah terdapat pada kulit elektron yang terletak paling dalam.
Sedangkan tingkat energi paling besar terletak pada kulit elektron paling luar. Semakin jauh dari inti atom (semakin besar nomor kulitnya) maka tingkat energinya akan semakin tinggi.
TEORI ATOM MODERN
1. Louis de Broglie (1924)
Di tahun 1924 Louis de Broglie menyatakan sebuah hipotesis dualisme partikel gelombang, seluruh materi yang dapat memiliki sifat yang menyerupai gelombang. Elektron mempunyai sifat seperti partikel, dan juga sifat yang seperti gelombang.2. Erwin Schrödinger (1926)
Di tahun 1926 Erwin Schrödinger merumuskan sebuah persamaan matematis, yang sekarang disebut dengan persamaan gelombang Schrödinger yang memperhitungkan sifat yang menyerupai partikel dan seperti gelombang dari elektron.3. Werner Heisenberg (1927)
Di tahun 1927, Werner Heisenberg mengajukan asas ketidakpastian dari Heisenberg yang menyatakan bahwa posisi eletron tidak dapat ditentukan dengan pasti. Tetapi hanya bisa ditentukan pada peluang posisinya saja.
4. James Chadwick (1932)
Di tahun 1932 James Chadwick menemukan partikel yang netral, yang disebut dengan neutron. Yang berasal dari eksperimen bombardir partikel α di berbagai unsur. Dengan demikian bisa disimpulkan bahwa di dalam model awan elektron, terdiri dari beberapa elektron yang muatannya negatif. Yang bergerak dengan sangat cepat, dan mengelilingi inti atom yang tersusun dari sebuah proton yang muatannya positif dan neutron yang tidak memiliki muatan.Oleh:
Nama : Lexy Fernando
NIM : C1061191062
Prodi : Ilmu Dan Teknologi Pangan
DAFTAR PUSTAKA
https://idschool.net/sma/perkembangan-teori-atom/https://enjiner.com/struktur-atom/
https://www.studiobelajar.com/teori-atom/
https://korangratis.net/teori-atom/
https://www.artikelsiana.com/2015/09/model-atom-thomson-pengertian-kelebihan.html
https://materisekolah.co.id/perkembangan-teori-atom-lengkap/





Mantap gan
BalasHapusSangat membantuu 👍👍
BalasHapusMantulll gaaan, smoga makin di perbanyak ya gan isinya 👍
BalasHapus👍👍👍
BalasHapusMantap
BalasHapusMantapp bangg.. Ditunggu postingan selanjutnyaa
BalasHapusGood👌
BalasHapusWah terimakasih💪
BalasHapus👍👍👍
BalasHapusGood job👏👏👏
BalasHapus👍👍👍
BalasHapusBagus bang, next
BalasHapusBagus
BalasHapusmantep gan
BalasHapussangat bermanfaat👏
BalasHapusmantap lex
BalasHapusManteppp👍🏻
BalasHapusMantappp om
BalasHapusMantappp om
BalasHapusNiceee
BalasHapusmantap sangan membantu
BalasHapusMantap!! sangat membantu bang
BalasHapus👍👍👍
BalasHapusniceee
BalasHapusbermanfaat sekali
BalasHapus👍
BalasHapus👍👍
BalasHapusbagus dan sangat bermanfaat
BalasHapusBaguss
BalasHapusSgt bermanfaat
BalasHapusKerren
BalasHapusSangat bermanfaat bagi seluruh kaum anak remaja bang bagus sekali saya sangat terhibur dengan ini semua,semoga sukses bang,adil ka talino bacuramin ka saruga basengat ka jubata,...arus arus arus��
BalasHapusMantap eh, sangat inspiratif sekali
BalasHapusMantep gan sangat membantu sekali
BalasHapusGood job
BalasHapusgood job
BalasHapus👍👍
BalasHapus